LEYES DE LOS GASES.
Cualquier muestra de un gas puede describirse en función de cuatro magnitudes: masa,
volumen, presión y temperatura. La investigación de estas magnitudes con el aire condujo a
establecer relaciones cuantitativas entre ellas, válidas para todos los gases.
LEY DE BOYLE-MARIOTTE:
PRESIÓN Y VOLUMEN
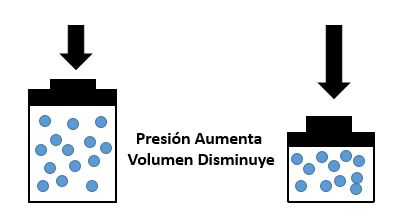
El que los gases son compresibles es un hecho familiar. Cuando se aumenta la presión sobre
una cantidad determinada de un gas, como sucede en una bomba neumática, el volumen del gas
disminuye: cuanto mayor es la presión menor se hace el volumen. En 1.660, el químico inglés
Robert Boyle estudió los efectos de la presión sobre el volumen de aire y observó que cuando
duplicaba la presión el volumen de aire se reducía a la mitad; si la presión se multiplica por cuatro
el volumen se reduce a la cuarta parte de su valor original, etc, (como se observa en la gráfica que
es una hipérbola). Esta relación ha resultado ser válida para cualquier gas.
En otras palabras, lo que Boyle encontró es que:
Para una determinada masa de gas el volumen es
inversamente proporcional a la presión ejercida, si la
temperatura se mantiene constante:
V= CONSTANTE.1/P
Se puede enunciar también de la siguiente forma:
"Para una misma masa de un gas a temperatura constante el producto del volumen del gas
por la presión que ejerce es constante"
P.V=CONSTANTE( T Y M CONSTANTES )
Esta relación es conocida como Ley de Boyle-Mariotte.
Una forma conveniente de escribir la ley de Boyle para comparar la misma muestra de gas,
a temperatura constante, bajo diferentes condiciones de presión y volumen, es
;
P1 . V1 = P2 . V2 = P3 . V3 ; (T y m constantes)
Si la presión y el volumen de una cantidad dada de un gas son inicialmente P1 y V1 y la
presión se cambia hasta P2, el nuevo volumen V2, viene dado por esta relación.
No hay comentarios:
Publicar un comentario